 |
Enzim
adalah satu atau beberapa gugus polipeptida (protein) yang berfungsi
sebagai katalis (senyawa yang mempercepat proses reaksi tanpa habis
bereaksi) dalam suatu reaksi kimia. Enzim bekerja dengan cara menempel
pada permukaan molekul zat-zat yang bereaksi dan dengan demikian
mempercepat proses reaksi. Percepatan terjadi karena enzim menurunkan
energi pengaktifan yang dengan sendirinya akan mempermudah terjadinya
reaksi.
Berdasarkan strukturnya, enzim terdiri atas komponen yang disebut apoenzim yang berupa protein dan komponen lain yang disebut gugus prostetik yang berupa nonprotein. Gugus prostetik dibedakan menjadi koenzim dan kofaktor. Koenzim berupa gugus organik yang pada umumnya merupakan vitamin, seperti vitamin B1, B2, NAD+ (Nicotinamide Adenine Dinucleotide). Kofaktor berupa gugus anorganik yang biasanya berupa ion-ion logam, seperti Cu2+, Mg2+, dan Fe2+.
Beberapa jenis vitamin seperti kelompok vitamin B merupakan koenzim.
Jadi, enzim yang utuh tersusun atas bagian protein yang aktif yang
disebut apoenzim dan koenzim, yang bersatu dan kemudian disebut holoenzim.
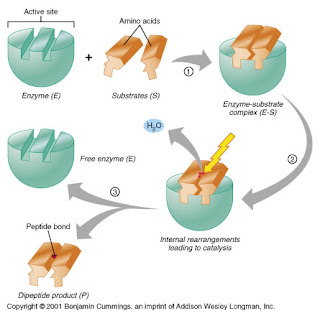
Enzim
bekerja dengan dua cara, yaitu menurut Teori Kunci-Gembok (Lock and Key
Theory) dan Teori Kecocokan Induksi (Induced Fit Theory). Menurut teori
kunci-gembok, terjadinya reaksi antara substrat dengan enzim karena
adanya kesesuaian bentuk ruang antara substrat dengan situs aktif
(active site) dari enzim, sehingga sisi aktif enzim cenderung kaku.
Substrat berperan sebagai kunci masuk ke dalam situs aktif, yang
berperan sebagai gembok, sehingga terjadi kompleks enzim-substrat. Pada
saat ikatan kompleks enzim-substrat terputus, produk hasil reaksi akan
dilepas dan enzim akan kembali pada konfigurasi semula. Berbeda dengan
teori kunci gembok, menurut teori kecocokan induksi reaksi antara enzim
dengan substrat berlangsung karena adanya induksi substrat terhadap
situs aktif enzim sedemikian rupa sehingga keduanya merupakan struktur
yang komplemen atau saling melengkapi. Menurut teori ini situs aktif
tidak bersifat kaku, tetapi lebih fleksibel.
Sebagai katalis dalam reaksi-reaksi di dalam tubuh organisme, enzim memiliki beberapa sifat, yaitu:
1. Enzim adalah protein, karenanya enzim bersifat thermolabil, membutuhkan pH dan suhu yang tepat.
2. Enzim bekerja secara spesifik, dimana satu enzim hanya bekerja pada satu substrat.
3. Enzim berfungsi sebagai katalis, yaitu mempercepat terjadinya reaksi kimia tanpa mengubah kesetimbangan reaksi.
4. Enzim hanya diperlukan dalam jumlah sedikit.
5. Enzim dapat bekerja secara bolak-balik.
6. Kerja enzim dipengaruhi oleh lingkungan, seperti oleh suhu, pH, konsentrasi, dan lain-lain.
1. Enzim adalah protein, karenanya enzim bersifat thermolabil, membutuhkan pH dan suhu yang tepat.
2. Enzim bekerja secara spesifik, dimana satu enzim hanya bekerja pada satu substrat.
3. Enzim berfungsi sebagai katalis, yaitu mempercepat terjadinya reaksi kimia tanpa mengubah kesetimbangan reaksi.
4. Enzim hanya diperlukan dalam jumlah sedikit.
5. Enzim dapat bekerja secara bolak-balik.
6. Kerja enzim dipengaruhi oleh lingkungan, seperti oleh suhu, pH, konsentrasi, dan lain-lain.
Faktor-faktor yang dapat mempengaruhi kerja enzim diantaranya adalah sebagai berikut.
1. Suhu
Enzim
tidak dapat bekerja secara optimal apabila suhu lingkungan terlalu
rendah atau terlalu tinggi. Jika suhu lingkungan mencapai 0° C atau
lebih rendah lagi, enzim tidak aktif. Jika suhu lingkungan mencapai 40° C
atau lebih, enzim akan mengalami denaturasi (rusak). Suhu optimal enzim
bagi masing-masing organisme berbeda-beda. Untuk hewan berdarah dingin,
suhu optimal enzim adalah 25° C, sementara suhu optimal hewan berdarah
panas, termasuk manusia, adalah 37° C.
2. pH (Tingkat Keasaman)
Setiap enzim mempunyai pH optimal masing-masing, sesuai dengan "tempat kerja"-nya. Misalnya
enzim pepsin, karena bekerja di lambung yang bersuasana asam, memiliki
pH optimal 2. Contoh lain, enzim ptialin, karena bekerja di mulut yang
bersuasana basa, memiliki pH optimal 7,5-8.
3. Aktivator dan Inhibitor
Aktivator
adalah zat yang dapat mengaktifkan dan menggiatkan kerja enzim.
Contohnya ion klorida, yang dapat mengaktifkan enzim amilase.
Inhibitor adalah zat yang dapat menghambat kerja enzim. Berdasarkan cara kerjanya, inhibitor terbagi dua, inhibitor kompetitif dan inhibitor nonkompetitif. Inhibitor kompetitif adalah inhibitor yang bersaing aktif dengan substrat untuk mendapatkan situs aktif enzim, contohnya sianida bersaing dengan oksigen dalam pengikatan Hb. Sementara itu, inhibitor nonkompetitif adalah inhibitor yang melekat pada sisi lain selain situs aktif pada enzim, yang lama kelamaan dapat mengubah sisi aktif enzim.
Inhibitor adalah zat yang dapat menghambat kerja enzim. Berdasarkan cara kerjanya, inhibitor terbagi dua, inhibitor kompetitif dan inhibitor nonkompetitif. Inhibitor kompetitif adalah inhibitor yang bersaing aktif dengan substrat untuk mendapatkan situs aktif enzim, contohnya sianida bersaing dengan oksigen dalam pengikatan Hb. Sementara itu, inhibitor nonkompetitif adalah inhibitor yang melekat pada sisi lain selain situs aktif pada enzim, yang lama kelamaan dapat mengubah sisi aktif enzim.
4. Konsentrasi enzim dan substrat
- Semakin tinggi konsentrasi enzim akan semakin mempercepat terjadinya reaksi. Dan konsentrasi enzim berbanding lurus dengan kecepatan reaksi.
- Jika sudah mencapai titik jenuhnya, maka konsentrasi substrat berbanding terbalik dengan kecepatan reaksi.
- Semakin tinggi konsentrasi enzim akan semakin mempercepat terjadinya reaksi. Dan konsentrasi enzim berbanding lurus dengan kecepatan reaksi.
- Jika sudah mencapai titik jenuhnya, maka konsentrasi substrat berbanding terbalik dengan kecepatan reaksi.
Dewasa
ini, enzim adalah senyawa yang umum digunakan dalam proses produksi.
Enzim yang digunakan pada umumnya berasal dari enzim yang diisolasi dari
bakteri. Penggunaan enzim dalam proses produksi dapat meningkatkan
efisiensi yang kemudian akan meningkatkan jumlah produksi.
Mekanisme
Enzim dapat bekerja dengan beberapa cara, yang kesemuaannya menurunkan ΔG‡:
- Menurunkan energi aktivasi dengan menciptakan suatu lingkungan yang mana keadaan transisi terstabilisasi (contohnya mengubah bentuk substrat menjadi konformasi keadaan transisi ketika ia terikat dengan enzim.)
- Menurunkan energi keadaan transisi tanpa mengubah bentuk substrat dengan menciptakan lingkungan yang memiliki distribusi muatan yang berlawanan dengan keadaan transisi.
- Menyediakan lintasan reaksi alternatif. Contohnya bereaksi dengan substrat sementara waktu untuk membentuk kompleks Enzim-Substrat antara.
- Menurunkan perubahan entropi reaksi dengan menggiring substrat bersama pada orientasi yang tepat untuk bereaksi. Menariknya, efek entropi ini melibatkan destabilisasi keadaan dasar, dan kontribusinya terhadap katalis relatif kecil.














